原子如何判断得失电子
更新时间:2024-10-12 14:32:34来源:鼎乐游戏浏览量:
在化学元素中,原子的得失电子数量决定了其化学性质,原子通过失去或吸收电子来实现稳定的电子排布,从而形成化学键和分子。电子的能力强弱对比也直接影响了原子的化学反应活性和化合价的大小。原子如何判断得失电子,以及电子能力的强弱对比,是化学研究中至关重要的课题。
电子能力强弱对比
具体方法:
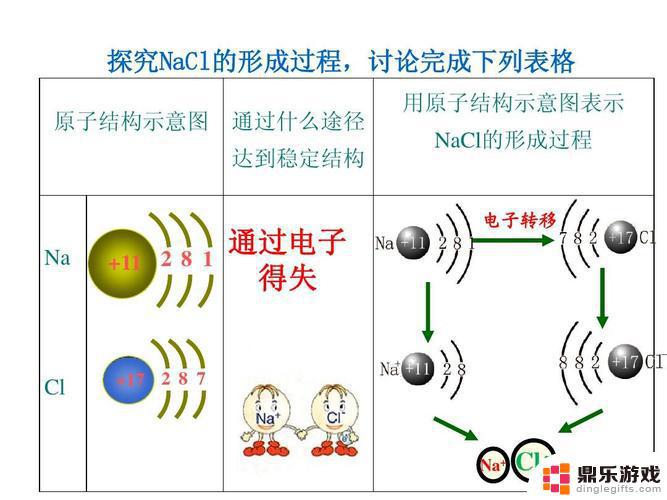
1.原子核内质子带正电,质子越多吸引力越强,和价层结构有关,如果达到稳定状态了,轨道全满或半充满,就很难得失电子,如稀有气体、过渡金属。此外,最外层电子越多,就越容易得电子,反之易失去.原子半径越小,易得电子,反之易失去。
2.具体看元素周期表,同周期(稀有气体除外)元素越靠后非金属性越大。氧化性越大,得电子的能力越弱,同主族元素越向下金属性越大 得电子能力越大,氧化性越强,得电子能力越强;非金属性越强,氧化性越强;一般来说在元素周期表中,越往下和右的,得电子能力越强。
以上就是原子如何判断得失电子的内容,看完本篇攻略,希望对各位玩家有所帮助!
- 上一篇: 多乐保皇怎么登别人的号
- 下一篇: 三国志战略版如何加好友
热门攻略
猜您喜欢
最新手机游戏
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10